Ikatan Kimia
1.Struktur Lewis
Spesies yang tersusun oleh khusunya unsur-unsur nonlogam seperti H2, O2, N2, H2O, HCl, dan CH4 ternyata mempunyai sifat yang berlawanan dengan sifat-sifat senyawa ionik, sifat tersebut misalnya bukan penghantar listrik. Oleh karena itu, pembentukan ikatan antara atom-atom penyusun molekul menurut model transfer elektron sebagaimana diterapkan untuk molekul ionik tidak lagi tepat. Pernyataan yang menantang para ahli kimia pada awal abad ke dua puluh perihal bagaimana atom-atom itu bergabung membentuk suatu molekul, dijawab oleh Gilbert N. Lewis pada tahun 1916 yang mengusulkan bahwa elektron valensi suatu atom dapat divisualisasikan seolah-olah menempati titik-titik sudut suatu kubus di seputar intinya. Suatu atom yang kekurangan elektron yang diperlukan untuk menempati kedelapan titik sudut kubus dapat mengadakan "persekutuan" melalui rusuk kubus dengan atom lain untuk melengkapi pemilikan oktet seperti pada gambar berikut:
Sebagaimana banyak ide revolusioner umumnya, ide Lewis ini juga ditolak oleh banyak ahli kimia pada waktu itu. Namun demikian konsep pembentukan pasangan-pasangan elektron sekutu kemudian dapat diterima walaupun model diagram kubus tersebut akhirnya hilang tidak mendapat dukungan. Pandangan klasik perihal ikatan kemudian segera berkembang dengan munculnya mekanika kuantum. Linus Pauling pada tahun 1937 mengenalkan model ikatan yang melibatkan tumpang tindih orbital atomik.
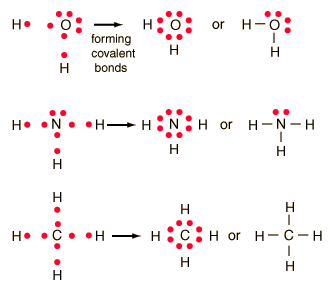
Lewis selanjutnya mengidentifikasi ikatan kimia sebagai pasangan elektron sekutu, meskipun tidak dapat menjelaskan mengapa pasangan elektron dan bukan jumlah yang lain harus bertanggungjawab dalam pembentukan ikatan. Pasangan elekron sekutu yang kemudian dikenal sebagai ikatan kovalen, dilukiskan sebagai ikatan tunggal A-B untuk sepasang elektron sekutu, ikatan rangkap dua A=B dan ganda tiga A≡B, masing-masing untuk dua dan tiga pasangan sekutu. Pembentukan pasangan elektron ini untuk mencapai konfigurasi elektron terluar delapan, oktet, seperti halnya dijumpai dalam gas mulia (kecuali He) yang ternyata stabil. Sebagai contoh adalah H2O (air), NH3 (amonia), dan CH4 (metana) sebagai berikut:
Untuk ion, biasanya muatan dilukiskan untuk satu keseluruhan dan bukan untuk atom secara individu, khususnya jika atom-atom pengelilingnya sama. Sebagai contoh adalah ion karbonat sebagai berikut:
2. Ikatan Ion
Pengertian Ikatan Ion
Secara sederhana, definisi ikatan ion adalah ikatan antara dua macam ion (kation dan anion) oleh gaya-gaya elektrostatik Coulomb. Namun, misalnya untuk senyawa kompleks [Fe(H2O)6]2+, ion pusat Fe2+ dengan molekul pengeliling H2O, juga sebagian besar diikat oleh gaya-gaya elektrostatik antara ion pusat dengan dipol listrik tetap yaitu negatif yang dihasilkan oleh molekul pengeliling. Oleh karena ikatan ion terjadi dengan cara transfer elektron, maka dapat diramalkan bahwa unsur-unsur golongan alkali dan alkali tanah dengan karakteristik ns(1-2) mempunyai kecenderungan yang cukup kuat untuk membentuk ikatan ionik dengan unsur-unsur golongan halogen dan oksigen dengan karakteristik ns2 np(4-5). Kenyataannya ditemui berbagai tipe ion dengan konfigurasi elektronik tertentu.Jenis-jenis Spesies Ion
Spesies tanpa elektron valensi
Ion hidrogen H+, barangkali dapat dipandang sebagai satu-satunya contoh spesies tanpa elektron valensi, meskipun eksistensinya distabilkan dalam bentuk tersolvasi oleh pelarut, yaitu sebagai ion hidronium, H3O+, dalam air.Spesies dengan dua elektron valensi
Beberapa spesies yang cukup stabil dengan dua elektron valensi adalah ion hidrida, H+, Li+, dan Be2+. Ion-ion ini mengadopsi konfigurasi elektronik gas mulia He.Spesies dengan delapan elektron valensi
Pembentukan spesies yang stabil dengan delapan elektron valensi adalah seperti Na+, Mg2+, F- dan O2-. Jadi, NaF, Na2O, MgF2, dan MgO merupakan contoh spesies ionik dengan mengadopsi konfigurasi elektron valensi gas mulia terdekat, Ne.Spesies dengan sembilan elektron valensi
Kenyataan bahwa banyak senyawa-senyawa golongan d juga bersifat ionik, sudah barang tentu kestabilan konfigurasi elektroniknya, khusunya jumlah elektron valensi, tidak lagi mengikuti kaidah oktet, tetapi mencapai delapan belas. Spesies ini banyak ditemui pada golongan 11, 12 bahkan juga golongan 13 mulai periode 4.Spesies dengan "delapan belas + dua" elektron valensi
Spesies ini umumnya terdiri atas unsur-unsur berat. Unsur 81Tl dijumpai sebagai kation Tl3+ yaitu sistem 18 elektron valensi yang cukup stabil. Namun demikian, kation Tl+ ternyata juga ditemui dan bahkan lebih stabil daripada kation Tl3+. Kestabilan sistem konfigurasi ini sering pula dikaitkan dengan kenyataan penuhnya semua orbital yang terisi, yang secara khusus dikenal sebagai sistem konfigurasi elektronik "18+2" atau dengan istilah spesies dengan pasangan elektron inert. Unsur-unsur Ga, In, dan Tl (golongan 13 tabel periodik), Ge, Sn, dan Pb (golongan 14) dan As, Sb, dan Bi (golongan 15) dapat membentuk secara berurutan ion-ion M+, M2+ dan M3+ yang khas dengan pasangan elektron inert, (4-6)s2.Spesies dengan berbagai macam elektron valensi
Ion-ion tipe ini terdiri atas unsur-unsur transisi golongan d dan f yang mempunyai konfigurasi elektronik d dan f belum penuh. Umumnya, ion-ion ini mempunyai konfigurasi elektronik terluar 8-18 yaitu ns2 np6 nd0-10 dengan n = 3, 4, 5. Tambahan pula, Unsur unsur golongan transisi dikenal dapat membentuk kation degan berbagai macam tingkat oksidasi.3. Ikatan Kovalen
Pengertian Ikatan Kovalen
Ikatan kovalen adalah ikatan kimia yang terjadi jika adanya penggunaan pasangan elektron secara bersama-sama oleh atom-atom yang berikatan. Dengan kata lain, pasangan elektron ini digunakan bersama-sama (shared electrons - elektron sekutu). Sebagai contoh sederhana adalah adanya ikatan kovalen yang terjadi antara unsur hidrogen dengan oksigen membentuk air (H2O). Masing-masing ikatan kovalen mengandung dua elektron, yaitu satu berasal dari hidrogen dan satunya lagi berasal dari oksigen.Atom berikatan kovalen dengan atom lain untuk mencapai kestabilan. Dengan adanya "penyekutuan" elektron valensi, atom dapat memenuhi orbital atom terluarnya dan mencapai kestabilan.
Ikatan Kovalen Polar dan Non Polar
Ikatan Kovalen Polar
Ikatan kovalen polar adalah ikatan kovalen yang terbentuk ketika elektron sekutu di antara atom tidak benar-benar dipakai bersama. Hal ini terjadi ketika satu atom mempunyai elektronegativitas yang lebih tinggi daripada atom yang lainnya. Atom yang mempunyai elektronegativitas yang tinggi mempunyai tarikan elektron yang lebih kuat. Akibatnya elektron sekutu akan lebih dekat ke atom yang mempunyai elektronegativitas tinggi. Dengan kata lain, akan menjauhi atom yang mempunyai elektronegativitas rendah. Ikatan kovalen polar menjadikan molekul yang terbentuk mempunyai potensial elektrostatis. Potensial ini akan membuat molekul lebih polar, karena ikatan yang terbentuk dengan molekul polar lain relatif lemah. Ilustrasi ikatan kovalen polar adalah sebagai berikut:Contoh senyawa kovalen polar adalah air, sulfida, ozon, dsb.
Ikatan Kovalen Non Polar
Ikatan kovalen nonpolar adalah ikatan kovalen yang terbentuk ketika atom membagikan elektronnya secara setara (sama). Biasanya terjadi ketika ada atom mempunyai afinitas elektron yang sama atau hampir sama. Semakin dekat nilai afinitas elektron, maka semakin kuat ikatannya. Ikatan kovalen nonpolar terjadi pada molekul gas, atau yang sering disebut sebagai molekul diatomik. Ikatan kovalen nonpolar mempunyai konsep yang sama dengan ikatan kovalen polar, yaitu atom yang mempunyai nilai elekronegativitas tinggi akan menarik elektron lebih kuat. Pernyataan tesebut benar, namun jika terjadi pada molekul diatom (dimana atom penyusunnya adalah sama) maka elektronegativitas juga sama. Ilustrasi ikatan kovalen nonpolar adalah sebagai berikut:Contoh senyawa kovalen nonpolar adalah gas hidrogen, gas nitrogen, dsb.
4. Ikatan Kovalen Koordinasi
Pengertian ikatan kovalen koordinasi
Pembahasan sebelumnya tentang ikatan kovalen telah menjelaskan bahwa pengertian ikatan kovalen adalah penggunaan bersama-sama pasangan "elektron sekutu" (sharing electron). Pembentukan pasangan elektron sekutu tidak harus selalu berasal dari kedua belah pihak atom yang berikatan, melainkan dapat berasal dari satu pihak saja, namun tetap menjadi milik bersama. Dengan demikian dalam kasus ini ada pihak penyumbang (donor) dan ada pihak penerima (akseptor) pasangan elektron. Ikatan demikian ini tentu saja merupakan ikatan kovalen dan sering dinyatakan secara khusus sebagai ikatan kovalen koordinasi atau ikatan kovalen koordinat dengan simbol tanda panah dari atom donor menuju akseptor, meskipun hal ini bukan suatu keharusan.Contoh ikatan kovalen koordinasi
Sebagai contoh ikatan kovalen koordinasi adalah senyawa amonia, NH3, terdiri atas tiga pasangan elektron sekutu untuk tiga ikatan kovalen tunggal N-H. Namun karena atom N memiliki lima elektron valensi, maka masih tersedia sepasang elektron bukan ikatan atau sepasang elektron menyendiri (lone pair electron). Jika molekul NH3 bergabung dengan ion H+ (hidrogen tanpa elektron) membentuk ion NH4+, maka hanya ada satu kemungkinan pembentukan pasangan elektron sekutu yang berasal dari atom N sebagai ikatan kovalen koordinasi, yang dapat dilukiskan menurut gambar berikut.Kenyataan bahwa keempat ikatan kovalen N-H mempunyai panjang ikatan yang sama menyarankan bahwa penggambaran khusus ikatan kovalen koordinasi tidak bermanfaat kecuali hanya mengindikasikan proses pembentukan pasangan elektron sekutu saja dan oleh karena itu muatan ion menjadi milik seluruh gugus amonium.
5. Ikatan Hidrogen
Pengertian Ikatan Hidrogen
Ikatan hidrogen adalah sebuah interaksi tarik-menarik (dipol-dipol) antara atom yang bersifat elektronegatif dengan atom hidrogen yang terikat pada atom lain yang juga bersifat
elektronegatif. Jadi, ikatan hidrogen tidak hanya terjadi pada satu
molekul, melainkan bisa antara molekul satu dengan molekul yang lainnya.
Ikatan hidrogen selalu melibatkan atom hidrogen. Inilah gambar
ilustrasi ikatan hidrogen:
Apabila atom hidrogen terikat pada atom lain, terutama F, O, N, atau Cl, sedemikian sehingga ikatan X-H bersifat sangat polar dengan daerah positif pada atom H, maka atom H ini dapat berinteraksi dengan spesies negatif lain atau spesies kaya elektron membentuk ikatan hidrogen (Xδ- - Hδ+•••Y ; H•••Y = ikatan hidrogen). Walaupun detilnya sangat bervariasi, tetapi umumnya dipercaya bahwa sifat khas gaya elektrostatik yang besar antara atom H dan Y. Konsekuensinya, jarak ikatan X-H dengan ikatan hidrogen akan menjadi lebih panjang, sekalipun tetap sebagai ikatan kovalen tunggal, daripada panjang ikatan normal X-H tanpa ikatan hidrogen. Demikian juga jarak H•••Y umumnya lebih panjang daripada jarak ikatan normal H-Y. Dalam hal ikatan hidrogen sangat kuat, jarak X•••Y menjadi sangat pendek dan panjang ikatan antara X-H dan H•••Y keduanya menjadi pendek dan hampir sama.
Dari studi kristalografik dapat diketahui bahwa dalam es setiap atom oksigen dikelilingi oleh empat atom-atom oksigen yang lain secara tetrahedral dan keempat atom-atom hidrogen terletak antara atom-atom oksigen sekalipun tidak tepat di tengahnya. Jadi, setiap atom O mengikat dua atom H dengan jarak yang sama ~1,01 Å dan dua atom H yang lain dengan jarak yang lebih panjang, ~1,75 Å, sebagai ikatan hidrogen. Jadi, jarak O-O ~2,76 Å. Struktur es ini terbuka dan distribusi ikatan hidrogen terbentuk secara acak. Jika es meleleh, maka sebagian ikatan hidrogen terputus sehingga struktur es tidak lagi dapat dipertahankan dan berakibat naiknya densitas air.
Sifat Kekuatan Ikatan Hidrogen
Ikatan hidrogen bersifat lebih kuat dibandingkan gaya van der Waals, tetapi lebih lemah dibandingkan ikatan kovalen maupun ikatan ion.Pembentukan Ikatan Hidrogen
Ikatan hidrogen sangat dominan dalam kimia air, larutan air, pelarut hidroksilik, spesies yang mengandung gugus -OH umumnya, dan penting juga dalam sistem biologi misalnya sebagai penghubung rantai polipetida dalam rantai protein dan pasangan basa dari asam nukleat.Apabila atom hidrogen terikat pada atom lain, terutama F, O, N, atau Cl, sedemikian sehingga ikatan X-H bersifat sangat polar dengan daerah positif pada atom H, maka atom H ini dapat berinteraksi dengan spesies negatif lain atau spesies kaya elektron membentuk ikatan hidrogen (Xδ- - Hδ+•••Y ; H•••Y = ikatan hidrogen). Walaupun detilnya sangat bervariasi, tetapi umumnya dipercaya bahwa sifat khas gaya elektrostatik yang besar antara atom H dan Y. Konsekuensinya, jarak ikatan X-H dengan ikatan hidrogen akan menjadi lebih panjang, sekalipun tetap sebagai ikatan kovalen tunggal, daripada panjang ikatan normal X-H tanpa ikatan hidrogen. Demikian juga jarak H•••Y umumnya lebih panjang daripada jarak ikatan normal H-Y. Dalam hal ikatan hidrogen sangat kuat, jarak X•••Y menjadi sangat pendek dan panjang ikatan antara X-H dan H•••Y keduanya menjadi pendek dan hampir sama.
Bukti Adanya Ikatan Hidrogen
Bukti adanya peran ikatan hidrogen yang mana cukup signifikan adalah perbandingan sifat fisik titik didih abnormal dari senyawa-senyawa NH3, HF, dan H2O. Kekuatan ikatan hidrogen dalam molekul-molekul secara berurutan adalah H2O > HF > NH3. Penyimpangan titik didih NH3, HF, dan H2O dalam hubungannya dengan titik didih senyawa-senyawa kovalen hidrida dari unsur-unsur dalam golongan yang sama menunjukkan peran ikatan hidrogen yang sangat jelas seperti gambar berikut ini: |
| Titik didih normal senyawa biner hidrogen golongan p |
Dari studi kristalografik dapat diketahui bahwa dalam es setiap atom oksigen dikelilingi oleh empat atom-atom oksigen yang lain secara tetrahedral dan keempat atom-atom hidrogen terletak antara atom-atom oksigen sekalipun tidak tepat di tengahnya. Jadi, setiap atom O mengikat dua atom H dengan jarak yang sama ~1,01 Å dan dua atom H yang lain dengan jarak yang lebih panjang, ~1,75 Å, sebagai ikatan hidrogen. Jadi, jarak O-O ~2,76 Å. Struktur es ini terbuka dan distribusi ikatan hidrogen terbentuk secara acak. Jika es meleleh, maka sebagian ikatan hidrogen terputus sehingga struktur es tidak lagi dapat dipertahankan dan berakibat naiknya densitas air.
Ikatan Hidrogen pada Spektroskopi
Bukti adanya ikatan hidrogen yang lebih signifikan adalah melalui studi kristalografik - sinar X, difraksi neutron, demikian juga spekrum infra merah dan Nuclear Magnetic Resonance (NMR) baik untuk padatan cairan, maupun larutan. Di dalam spektrum inframerah, untuk senyawa X-H yang mengandung ikatan hidrogen, maka energi vibrasi - stretching X-H akan menjadi melemah hingga akan muncul pada spektrum dengan frekuensi yang lebih rendah dan melebar - tumpul.6. Ikatan Logam
Pengertian Ikatan Logam
Lebih dari delapan puluh unsur yang ada di sistem periodik unsur
adalah logam. Logam bersifat padat pada temperatur dan tekanan standar,
dengan pengecualian unsur merkuri dan galium yang keduanya berupa
cairan. Sebagai pengingat, sifat-sifat logam adalah sebagai berikut:
Sifat-sifat logam tidak dapat dimasukkan dalam kriteria ikatan seperti ikatan kovalen maupun ikatan ion. Senyawa ionik tidak dapat mengantarkan listrik pada fase padatan, dan senyawa ionik bersifat rapuh (berlawanan dengan sifat logam). Atom dari senyawa logam hanya mengandung satu sampai tiga elektron valensi. Dengan demikian atom tersebut tidak mampu membentuk ikatan kovalen. Senyawa kovalen merupakan penghantar listrik yang buruk dan umumnya berupa cairan (dengan sifat berkebalikan dengan pembentukan logam). Dengan demikian, logam membentuk model ikatan yang berbeda.
Skema ikatan logam dapat dilihat pada gambar di bawah ini. Elektron valensi menjadi terdisosiasi dengan inti atomnya dan membentuk lautan elektron.
Contoh ikatan unsur yang mempunyai ikatan logam adalah sebagian besar logam seperti Cu, Al, Au, Ag, dsb. Logam transisi seperti Fe, Ni, dsb membentuk ikatan campuran yang terdiri dari ikatan kovalen (pada elektron 3d) dan ikatan logam.
- Mempunyai konduktivitas termal dan listrik yang tinggi.
- Berkilau dan memantulkan cahaya.
- Dapat ditempa.
- Mempunyai variasi kekuatan mekanik.
Sifat-sifat logam tidak dapat dimasukkan dalam kriteria ikatan seperti ikatan kovalen maupun ikatan ion. Senyawa ionik tidak dapat mengantarkan listrik pada fase padatan, dan senyawa ionik bersifat rapuh (berlawanan dengan sifat logam). Atom dari senyawa logam hanya mengandung satu sampai tiga elektron valensi. Dengan demikian atom tersebut tidak mampu membentuk ikatan kovalen. Senyawa kovalen merupakan penghantar listrik yang buruk dan umumnya berupa cairan (dengan sifat berkebalikan dengan pembentukan logam). Dengan demikian, logam membentuk model ikatan yang berbeda.
Model Lautan Elektron
Untuk menjelaskan ikatan pada logam, Lorentz mengusulkan sebuah model yang dikenal dengan model gas elektron atau model lautan elektron. Model ini didasarkan pada sifat logam berikut:Energi ionisasi yang rendah
Logam umumnya mempunyai energi ionisasi yang rendah. Secara tak langsung, pengertian ini merujuk pada elektron valensi yang tidak terikat dengan kuat oleh inti. Elektron valensi dapat bergerak dengan bebas diluar pengaruh inti. Dengan demikian, logam mempunyai elektron yang bebas bergerak.Banyak orbital kosong
Telah diteliti bahwa logam mempunyai banyak orbital yang kosong sebagai akibat elektron valensi logam lebih rendah daripada orbital valensi logam. Sebagai contoh, logam litium mempunyai orbital 2p yang kosong; natrium mempunyai orbital 3p dan 5d yang kosong; dan magnesium mempunyai orbital 3p dan 3d yang juga masih kosong.Contoh Ikatan Logam
Elektron yang paling luar pada sebagian besar logam biasanya mempunyai hubungan yang tidak erat dengan ini karena letaknya yang jauh dari muatan positif inti. Semua elektron valensi logam-logam bergabung membentuk lautan elektron yang bergerak bebas di antara inti atom. Elektron yang bergerak bebas beraksi sebagai ikatan terhadap ion bermuatan positif. Ikatan logam tidak mempunyai arah. Akibatnya, ikatan tidak rusak ketika logam ditempa.Skema ikatan logam dapat dilihat pada gambar di bawah ini. Elektron valensi menjadi terdisosiasi dengan inti atomnya dan membentuk lautan elektron.
Contoh ikatan unsur yang mempunyai ikatan logam adalah sebagian besar logam seperti Cu, Al, Au, Ag, dsb. Logam transisi seperti Fe, Ni, dsb membentuk ikatan campuran yang terdiri dari ikatan kovalen (pada elektron 3d) dan ikatan logam.








Comments
Post a Comment