Rumus Kimia,Persamaan Reaksi dan Stoikiometri
1.Persamaan Reaksi KimiaSebuah persamaan kimia merupakan sebuah cara singkat untuk menjelaskan peristiwa yang terjadi dalam perubahan kimia atau reaksi. Metode untuk merepresentasikan reaksi kimia dengan bantuan simbol-simbol dan rumus dari unsur yang terlibat di dalamnya dikenal sebagai persamaan kimia.
Beberapa hal yang penting mengenai reaksi kimia adalah:
- Zat yang saling bergabung atau bereaksi dikenal sebagai reaktan / pereaksi.
- Zat baru yang dihasilkan dalam reaksi dikenal sebagai produk.
- Reaktan ditulis di sisi kiri dipisahkan oleh tanda +.
- Produk ditulis di sebelah kanan, juga dipisahkan oleh tanda +.
- (g) berarti gas.
- (l) berarti cair.
- (s) berarti padat.
- (aq) menunjukkan suatu larutan berair atau yang dilarutkan dalam air.
- Angka di depan rumus atau simbol disebut koefisien.
- Kondisi yang diperlukan untuk reaksi yang ditentukan di atas atau di bawah panah.
Contoh berikut menggambarkan aspek-aspek dari persamaan kimia:
- Kapur ketika dipanaskan menghasilkan kalsium oksida padat dan gas karbon dioksida.
- Elektrolisis air dalam bentuk cair menghasilkan gas hidrogen dan oksigen.
PENTING
- Koefisien dari suatu reaksi kimia menunjukkan jumlah relatif (meskipun tidak mutlak) reaktan dan produk
- o biasanya menunjukkan jumlah terkecil dari atom, molekul atau ion yang akan memenuhi hukum kekekalan massa
- Massa relatif dari reaktan dan produk dari reaksi kimia dapat ditentukan dari koefisien reaksi ini
- Dapat mengkonversi mol ke massa dalam gram dengan mengalikan dengan massa relatif
- Persamaan kimia memberikan informasi kuantitatif yang berguna tetapi TIDAK memberikan indikasi apakah atau tidak pernah reaksi akan berlangsung
2.Konsep Dasar Perhitungan Stoikiometri
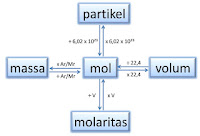 Konsep dasar perhitungan stoikiometri.
Stoikiometri merupakan sesuatu yang amat vital dan fatal dalam
perhitungan kimia. Segala perhitungan dalam reaksi kimia melibatkan
stoikiometri. Konsep mol merupakan kelanjutan dari stoikiometri. Untuk,
di sini akan dibahas konsep dasar perhitungan reaksi kimia dengan
stoikiometri. Subjek stoikiometri melibatkan perhitungan kuantitatif
berdasarkan rumus kimia dan persamaan kimia.
Konsep dasar perhitungan stoikiometri.
Stoikiometri merupakan sesuatu yang amat vital dan fatal dalam
perhitungan kimia. Segala perhitungan dalam reaksi kimia melibatkan
stoikiometri. Konsep mol merupakan kelanjutan dari stoikiometri. Untuk,
di sini akan dibahas konsep dasar perhitungan reaksi kimia dengan
stoikiometri. Subjek stoikiometri melibatkan perhitungan kuantitatif
berdasarkan rumus kimia dan persamaan kimia.1. Massa Molekuler dan Rumus Massa
Massa molekuler dan rumus massa adalah massa yang dinyatakan dalam massa atom (u) dari molekul individu dan unsur gabungan. Semua dihitung dari massa atom dalam rumus empiris atau rumus molekul. Massa molekul hanya berlaku untuk senyawa molekul, rumus massa digunakan untuk senyawa ionik.
2. Mol dan bilangan Avogadro
Satu mol adalah jumlah partikel yang relatif terhadap 12 g karbon-12. Bilangan ini disebut bilangan Avogadro yaitu 6,022 × 1023 mol-1. Mol adalah unit SI untuk jumlah zat dan digunakan secara luas dalam persamaan dan perhitungan kimia.
3. Massa mol dan massa molar
Massa satu mol zat disebut sebagai massa molar. Konversi antara jumlah mol dan jumlah gram zat memerlukan massa molar sebagai faktor konversi. Perhitungan yang melibatkan volume, kepadatan, dan jumlah atom atau molekul juga dapat digunakan untuk menentukan bilangan molar.
4. Komposisi Persen Massa
Persentasi massa unsur-unsur individu dalam suatu senyawa dapat ditentukan dari rumus kimia dan massa molar dengan persamaan berikut:
Kombinasi dari massa senyawa disebut sebagai komposisi persen massa
5. Rumus Kimia dari Komposisi Persen Massa
Sebuah rumus empiris dapat dibentuk dari komposisi persen massa senyawa dengan menghitung rasio molar dari unsur-unsur yang berbeda. Rumus empiris yang dihitung dengan cara ini mungkin bisa sama dengan rumus molekul. Untuk membuat rumus molekul, kita juga harus mengetahui massa molekul.
6. Percobaan Penentuan Komposisi Persen Massa
Persen massa karbon, hidrogen, dan oksigen dalam senyawa organik dapat ditentukan dengan analisis pembakaran. Metode lain yang diperlukan untuk menentukan komposisi persen massa adalah menggunakan senyawa anorganik.
7. Menulis dan Menyetarakan Persamaan Kimia
Persamaan kimia menggunakan simbol-simbol dan rumus untuk unsur atau senyawa yang terlibat dalam reaksi. Sebuah persamaan kimia menggambarkan reaksi, ditunjukkan oleh panah, dari reaktan ke produk. Koefisien stoikiometrik ditempatkan sebelum simbol atau rumus dalam persamaan untuk menyeimbangkan persamaan. Sebagaimana dipersyaratkan oleh hukum kekekalan massa, setiap unsur berjumlah sama baik di sisi produk maupun di sisi reaktan.
8. Stoikiometri Reaksi
Stoikiometri melibatkan hubungan kuantitatif dalam reaksi kimia. Faktor stoikiometri atau dikenal dengan rasio mol didasarkan pada koefisien dalam persamaan setara dan digunakan untuk menghubungkan reaktan atau produk. Massa molar dan faktor stoikiometrik digunakan untuk mengetahui informasi tentang salah satu reaktan atau produk dalam reaksi kimia. Strategi untuk perhitungan stoikiometri reaksi dapat diuraikan dengan diagram di bawah ini.
9. Pereksi Pembatas
Pereaksi pembatas dalah pereaksi yang benar-benar habis digunakan dalam reaksi. Jumlah teoritis dari produk yang terbentuk dapat ditentukan dari pereaksi pembatas. Pereaksi yang lain disebut pereaksi berlebih. Dalam stoikiometri, pereaksi pembatas harus ditentukan terlebih dahulu.
10. Persen Hasil
Dihitung secara teoritis dari pereaksi. Kuantitas yang diperoleh dari reaksi kimia,atau yang disebut hasil eksperimen, sering kurang dan umumnya dinyatakan sebagai persentase dari hasil teoritis.
11. Larutan dan Stoikiometri Larutan
Larutan dibuat dengan melarutkan satu zat terlarut pada suatu pelarut. Zat terlarut biasanya berjumlah lebih rendahsedikit. Molaritas (M) atau konsentrasi molar larutan adalah jumlah mol zat terlarut per liter larutan.
Pengenceran merupakan peningkatan volume pelarut. Tetapi jumlah zat terlarut tidak berubah. Akibatnya, konsentrasi menurun. Perhitungan reaksi stoikiometri dalam larutan untuk sering menggunakan molaritas sebagai faktor konversi.
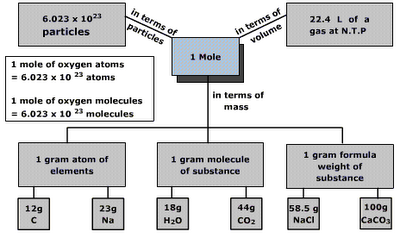
3.Konsep Mol
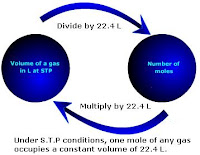 Konsep mol. Konsep mol diperlukan dalam reaksi kimia.Namun yang akan
dibahas disini adalah konsep mol yang berhubungan dengan volume gas.
Gambar di samping merupakan suatu konversi jika satu mol gas dikonversi
menjadi volume. Inilah pembahasan konsep mol secara lengkap.
Konsep mol. Konsep mol diperlukan dalam reaksi kimia.Namun yang akan
dibahas disini adalah konsep mol yang berhubungan dengan volume gas.
Gambar di samping merupakan suatu konversi jika satu mol gas dikonversi
menjadi volume. Inilah pembahasan konsep mol secara lengkap.Karena tidak mungkin untuk menghitung berat partikel secara individual, jumlah partikel yang disebut mol dipakai untuk semua tujuan praktis. Avogadro menemukan bahwa dalam kondisi suhu dan tekanan standar (1 ATM dan 273 K) sampel gas menempati volume 22,4 L. Jadi, satu mol gas mempunyai volume sebanyak 22,4 L.
Hal ini ditemukan bahwa jumlah atom dalam 12 g karbon adalah 6,023 x 1023 atom. Hal ini disebut sebagai bilangan Avogadro.
Dalam satu mol gas terdapat sebanyak 6,023 x 1023 partikel.
Bilangan Avogadro adalah jumlah atom dalam isotop C12 = 12 g C
Lihat Juga :Perhitungan Kimia
4.Konsep Mol Dalam Hal Ion,Nomor Massa dan Volume
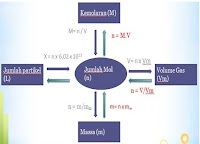 Konsep mol dalam hal ion, nomor massa dan volume. Seperti pada
pembahasan sebelumnya, konsep mol sangat diperlukan dalam setiap
perhitungan kimia. Mol merupakan jumlah atom, molekul, ion atau
elektron. Perhitungan kimia biasa menggunakan 'mol' dari atom, molekul,
ion atau elektron.
Konsep mol dalam hal ion, nomor massa dan volume. Seperti pada
pembahasan sebelumnya, konsep mol sangat diperlukan dalam setiap
perhitungan kimia. Mol merupakan jumlah atom, molekul, ion atau
elektron. Perhitungan kimia biasa menggunakan 'mol' dari atom, molekul,
ion atau elektron.Mol didefinisikan sebagai jumlah zat yang berisi jumlah unit kimia (atom, molekul, ion atau elektron). Satu mol mengandung sebanyak 6,023 x 1023 unit kimia, atau yang disebut sebagai bilangan Avogadro
Misalnya:
- Satu mol atom hidrogen = 6,023 x 1023 atom hidrogen
- Satu mol molekul hidrogen = 6,023 x 1023 molekul hidrogen
- Satu mol elektron = 6,023 x 1023 elektron
- Satu mol ion natrium (Na+) = 6,023 x 1023 ion Na+
Kesimpulannya adalah:
- Satu mol atom = 6,023 x 1023 atom = Gram massa atom unsur.
- Satu mol molekul = 6,023 x 1023 molekul = Gram massa molekul.
Volume molar
Volume yang ditempati oleh satu mol zat disebut volume molar. Hal ini dilambangkan dengan Vm. Volume molar zat tergantung pada suhu dan tekanan. Satu mol semua benda gas pada 273 K dan tekanan 1 atm menempati volume sebesar 22,4 liter atau 22.400 mL. Satuan volume molar adalah liter per mol atau mililiter per mol.
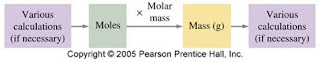
Hubungan mol dapat diringkas sebagai berikut:

Comments
Post a Comment